Les protéines sont des macromolécules. Elles sont formées par l’association de molécules plus petites, les acides-aminés. Il existe 20 acides aminés naturels que l’on retrouve dans les protéines de la totalité des êtres vivants connus, et qui présentent une grande variété de tailles, de formes et de propriétés chimiques.
Si on attache un petit nombre d’acides aminés les uns à la suite des autres (de deux à quelques dizaines) on parle de peptide. Dans le cas d’une chaîne plus longue, on a alors affaire à une protéine. La diversité des acides aminés et de leurs combinaisons est à l’origine de la diversité structurale et fonctionnelle des protéines.
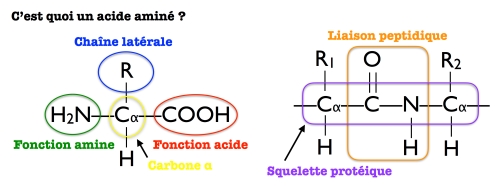 Dans les acides aminés on trouve majoritairement du carbone, de l’hydrogène, de l’azote et de l’oxygène, et puis aussi parfois un peu de soufre. Tous les acides aminés comportent un atome de carbone central (dit souvent carbone α) relié à une fonction amine d’une part et une fonction acide d’autre part.
Dans les acides aminés on trouve majoritairement du carbone, de l’hydrogène, de l’azote et de l’oxygène, et puis aussi parfois un peu de soufre. Tous les acides aminés comportent un atome de carbone central (dit souvent carbone α) relié à une fonction amine d’une part et une fonction acide d’autre part.
Le carbone α est également relié à une série d’atomes qui caractérise l’acide aminé considéré et que l’on appelle la chaîne latérale (notée R de manière générale).
Dans une protéine, les fonctions amine et acide de deux acides aminés successifs ont réagi entre elles pour former une liaison peptidique et une molécule d’eau. L’enchaînement liaison peptidique/carbone α/liaison peptidique… constitue alors le squelette de la protéine.
Au sein d’un acide aminé et dans le cadre de la liaison peptidique, les atomes sont reliés entre eux par des liaisons covalentes (cf. le billet De Bohr à la vinaigrette). Ce type de liaison particulièrement robuste résulte de la mise en commun d’un ou deux électrons par chacun des atomes impliqués dans celle-ci. Notez que cette garde partagée des électrons n’est pas toujours parfaitement équitable, certains atomes (tels que l’oxygène et l’azote) sont plus électronégatifs que d’autres (les atomes de carbone et d’hydrogène) et vont avoir tendance à capter les électrons vers eux. Dans ce cas on dira que la liaison, et du même coup la molécule qui la contient, sont polaires.
 Lorsque la chaîne d’acides aminés se replie sur elle même, il peut également se former également d’autres types de liaisons, covalentes ou non :
Lorsque la chaîne d’acides aminés se replie sur elle même, il peut également se former également d’autres types de liaisons, covalentes ou non :
- Les ponts disulfure sont les liaisons covalentes qui vont se former entre deux atomes de soufre portés par des cystéines.
- Les liaisons ioniques, dites aussi ponts salins, se forment entre des atomes portant des charges opposées.
- Les liaisons hydrogène apparaissent lorsqu’un atome d’hydrogène est pris en sandwich entre deux atomes plus électronégatifs que lui (oxygène ou azote). Une liaison hydrogène sera d’autant plus forte que les trois atomes impliqués dans celle-ci sont bien alignés.
- Les liaisons de van der Waals entraînent un regroupement des chaînes latérales non-polaires loin du solvant aqueux (qui est lui polaire).
Ces trois derniers types de liaisons sont dit non-covalents, les atomes associés ne vont pas partager d’électrons. Les liaisons non-covalentes sont beaucoup moins costaudes que les liaisons covalentes, mais elles sont néanmoins essentielles pour donner à la protéine sa structure tridimensionnelle. Elles sont également à l’origine des interactions qui peuvent se former entre plusieurs protéines.

Dans chaque type d’acide aminé, la chaîne latérale présente des propriétés chimiques particulières qui vont influer sur la structure et la fonction de la protéine dont il fait partie. Les acides aminés non polaires, hydrophobes, vont surtout se retrouver au cœur de la protéine, tandis que les résidus hydrophiles (ou polaires) et parfois chargés se retrouvent préférentiellement à la surface de la protéine, en contact avec le solvant aqueux.


Pont salin n’est pas synonyme de liaison ionique, c’est la combinaison d’une liaison ionique ET d’une liaison hydrogène :
J’aimeJ’aime