La dégradation de l’alcool par notre organisme se fait au niveau du foie, où l’éthanol est d’abord métabolisé en acétaldehyde, qui est lui même transformé en acide acétique. Or c’est cet intermédiaire, l’acétaldéhyde qui est impliqué dans les effets toxiques de la consommation d’alcool, en étant par example à l’origine de cirrhoses ou de cancers. Récemment, une équipe de recherche suisse a mis au point une méthode de dégradation de l’alcool qui permet de sauter l’étape acétaldéhyde, et ce nouveau procédé repose (qui l’eut cru ?) sur une protéine.
On vous a déjà parlé sur ce blog des caséines, ces protéines aux multiples fonctions, mais le lait contient plein d’autres protéines intéressantes, et parmi elles les β-lactoglobulines qui sont les principales proteines que l’on peut récupérer dans le petit lait bovin ou ovin.
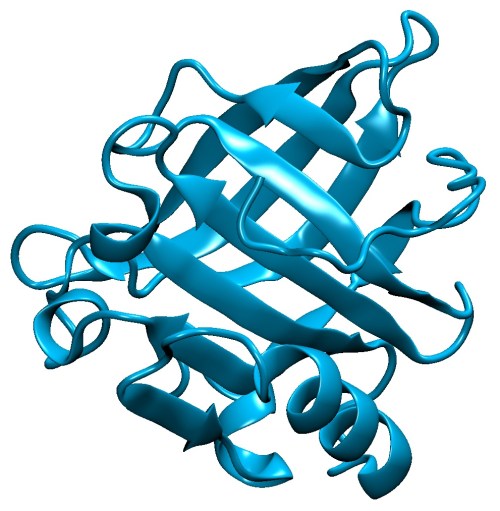
Cette petite protéine (qui est absente du lait humain) est un des allergènes connus du lait de vache, mais son plus haut fait d’arme est sans doute d’avoir traumatisé des générations d’enfants (et d’adultes) à l’heure du petit déjeuner, puisqu’elle est à l’origine de la peau que l’on peut parfois trouver à la surface d’un bol de lait chaud.

En effet, la β-lactoglobuline possède la propriété de former un gel composé de longues fibres aggrégées (un peu comme les amyloïdes, mais sans la toxicité) lorsqu’elle est soumise à des conditions dénaturantes (chaleur ou acidité). Et cette caractéristique a été exploitée par les chercheur·euses, ainsi que la présence de nombreuses glutamines, qui sont des acides-aminés comportant un atome d’azote au bout de leur chaîne latérale, dans la séquence de la protéine. Après avoir transformé la β-lactoglobuline en gel suite à un traitement de choc (cinq heures à 90°C et pH 2) l’équipe a rajouté des atomes de fer qui ont été captés par les azotes des glutamines, pour aboutir à la formation d’une nanozyme (pour nanomatériaux et enzyme). L’analyse de l’environnement des atomes de fer dans le gel protéique a montré que celui-ci était très proche de la structure trouvée dans le site catalytique de la horseradish peroxidase (HRP), une enzyme capable de catalyser les réactions d’oxydation. Ainsi ce gel permet la conversion de l’éthanol en acide acétique, mais sans passer par la case acétaldéhyde.
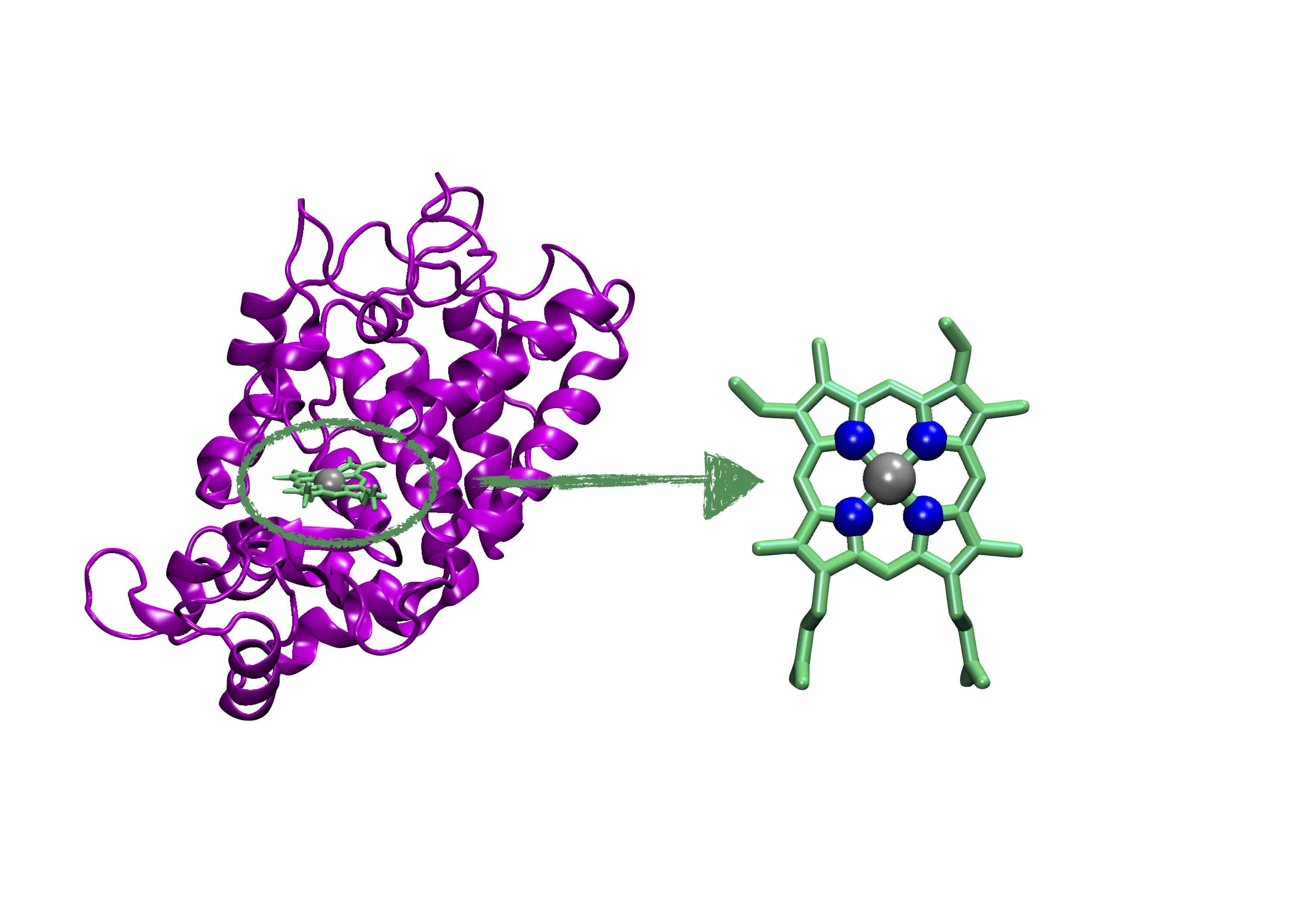
Le gel de β-lactoglobuline enrichi en fer a ensuite été testé sur des souris intoxiquées à l’alcool, et les études ont montré que le gel peut résister aux enzymes digestives durant plusieurs heures, que les rongeurs ainsi traités voient leur taux d’alcoolémie diminuer de manière conséquente, et qu’ils se remettent mieux de l’alcoolisation que leurs congénères non traités (on notera néanmoins qu’ils se portent toujours moins bien que les souris non exposées à l’alcool). Cette stratégie de dégradation de l’éthanol, qui va prendre place dans le système digestif et non dans le foie, nécessite cependant une prise préventive du gel et ne peut donc rien contre l’alcool qui serait déjà passé dans le système sanguin. Elle représente néanmoins une innovation notable dans la lutte contre une molécule qui accompagne l’humanité depuis ses débuts, mais représente encore un problème de santé publique majeur.
Pour en savoir plus :
- Une interview du Pr. Mezzenga (dernier auteur de l’étude publiée dans Nature Biotechnology) dans le podcast Avec Sciences.
