On a déjà fait connaissance avec les histones sur ce blog dans le billet consacré à la chromatine, cet assemblage complexe de protéines et d’ADN qui permet au cellules eucaryotes de bien ranger et protéger leur matériel génétique.

Chez les eucaryotes, les histones sont des protéines abondantes et remarquablement bien conservées d’une espèce à l’autre. Ils présentent tous le même repliement en trois hélices α et se différencient principalement par leurs extrémités N- et C-terminales (qui peuvent être la cible de modifications post-traductionnelles). On retrouve également des histones chez les archées, mais cette fois l’assemblage d’histones autour duquel l’ADN va s’enrouler peut varier en forme et en taille. Cette famille du vivant s’appuie également sur d’autres protéines (les NAP, pour Nucleoid Associated Proteins, puisqu’à la place d’un noyau bien délimité par une membrane, les cellules procaryotes contiennent un nucléoïde aux contours flous qui contient la plus grande partie du matériel génétique) pour ranger leur ADN.
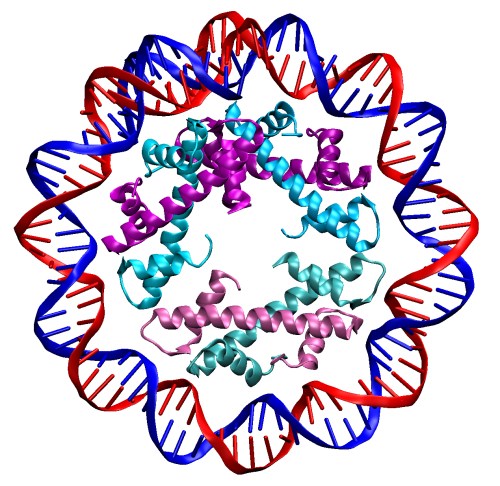
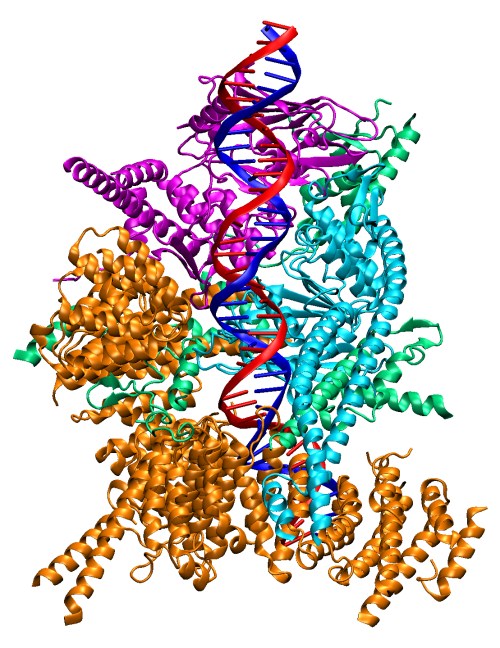
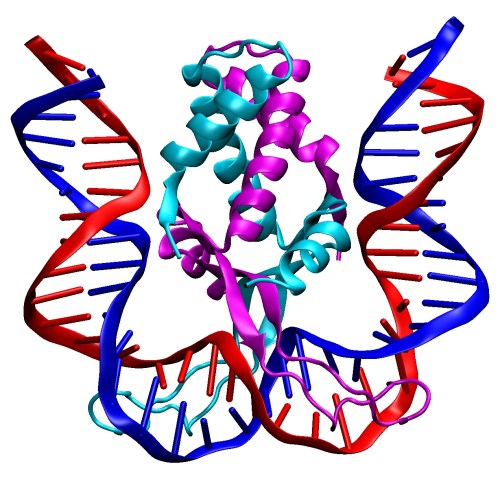
Par contre, on a longtemps considéré que les bactéries étaient dépourvues d’histones, et n’utilisaient que d’autres NAP pour compacter leur ADN, en générant notamment des structures avec des boucles et des sur-enroulements au lieu des petites bobines de nucléosome des eucaryotes. Des études d’homologie ont bien mis en évidence des protéines bactériennes dont la séquence se rapprochait de celle des histones des eucaryotes, mais il restait encore à déterminer leur fonction au sein de la cellule, et la façon dont elles pouvaient interagir avec l’ADN. Ce mystère a été récemment résolu par l’équipe de recherche de Karolin Luger (à laquelle on devait déjà la détermination de la structure du nucléosome des eucaryotes), et la structure obtenue s’est avérée des plus étonnantes. Après avoir identifié chez B. bacteriovorus (une bactérie qui parasite d’autres bactéries) deux protéines susceptibles de présenter un repliement similaire à celui des histones, les scientifiques ont d’abord montré que ces protéines étaient indispensables à la survie bactérienne (alors que d’ordinaires ces organismes tolèrent bien la suppression d’une ou plusieurs de leurs NAP). Dans un second temps, les structures obtenues par cristallographie de l’assemblage protein-ADN montrent que, contrairement à ce qui est observé chez les eucaryotes, les histones bactériens ne s’assemblent pas entre eux pour former une petite bobine autour de laquelle l’ADN va s’enrouler. On observe même le phénomène inverse, avec des histones qui vont se placer tout autour double brin d’ADN (qui reste alors rectiligne), formant ainsi une gaine protéique.
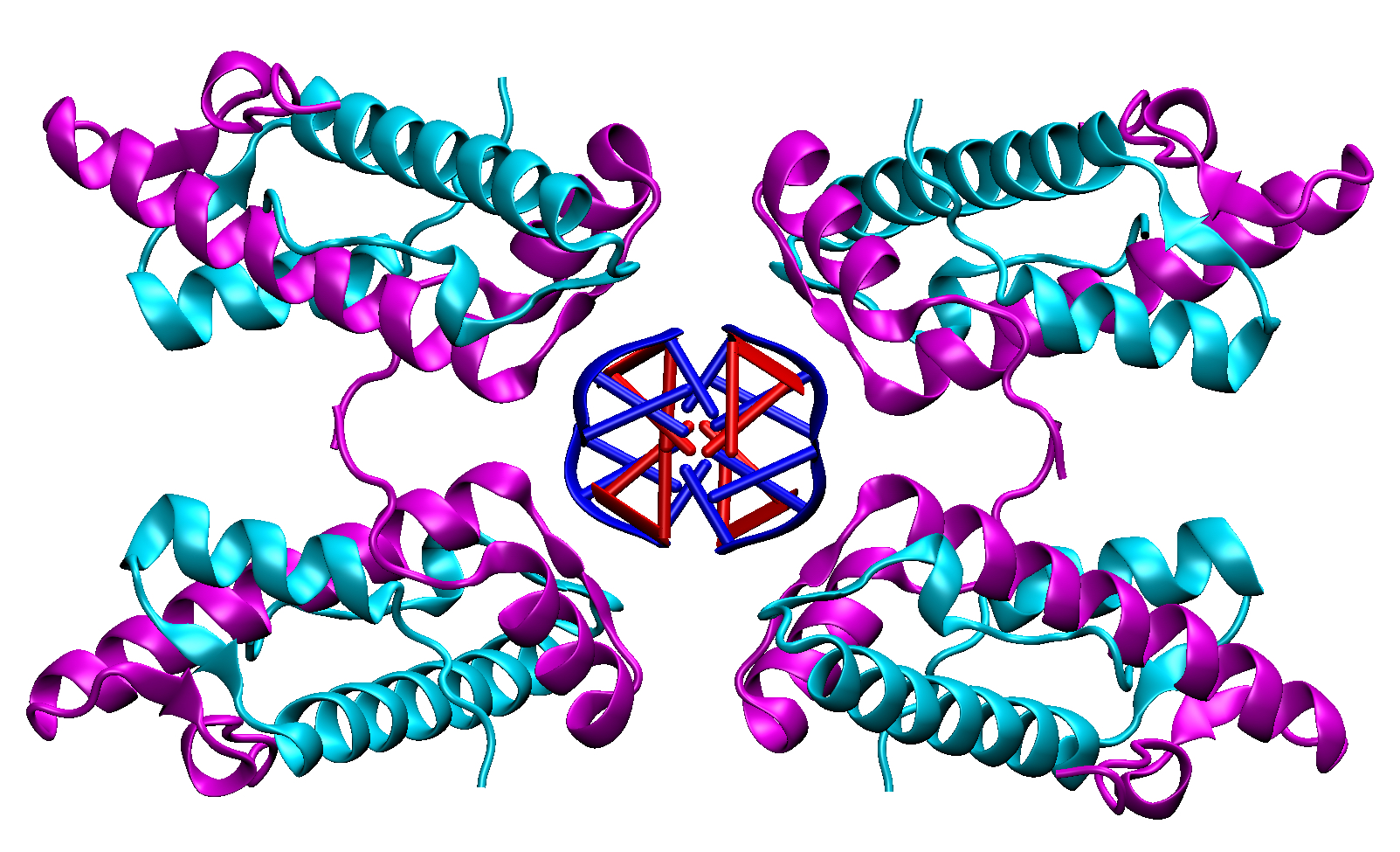
Il reste maintenant à comprendre quel rôle joue cet emballage dans la cellule, s’agit-il de protéger l’ADN bactérien ? De réguler son accès aux protéines chargées de sa transcription ? Les études sont toujours en cours. Mais cette structure inattendue vient encore une fois souligner l’immense inventivité du vivant, capable de générer des structures variées en partant d’éléments similaires. De plus, en améliorant notre compréhension du nucléoïde des bactéries, ce travail nous donne également des armes nouvelles pour lutter contre celles-ci.
